商机详情 -
衢州病理切片免疫组化实验流程
免疫组化SP三步法实验流程如下:一、切片准备1.石蜡切片脱蜡至水。一般使用二甲苯脱蜡,然后梯度酒精水化。2.进行抗原修复。可采用热修复或酶修复等方法,目的是暴露抗原决定簇。二、免疫反应1.阻断内源性过氧化物酶。使用3%过氧化氢溶液处理切片,减少非特异性染色。2.滴加一抗。一抗是针对目标抗原的特异性抗体,在湿盒中孵育,使一抗与抗原充分结合。3.滴加生物素标记的二抗。二抗能特异性识别一抗,孵育后清洗切片,去除未结合的二抗。4.滴加链霉亲和素-过氧化物酶复合物(SP)。SP能与二抗上的生物素结合,孵育后清洗。三、显色与复染**1.用DAB显色液显色,阳性部位会呈现棕黄色。显色时间根据具体情况调整。2.苏木精复染细胞核,使细胞核呈蓝色。3.脱水、透明、封片。经过梯度酒精脱水,二甲苯透明后,用中性树胶封片,便于观察。免疫组化可分析细胞内蛋白的表达水平。衢州病理切片免疫组化实验流程
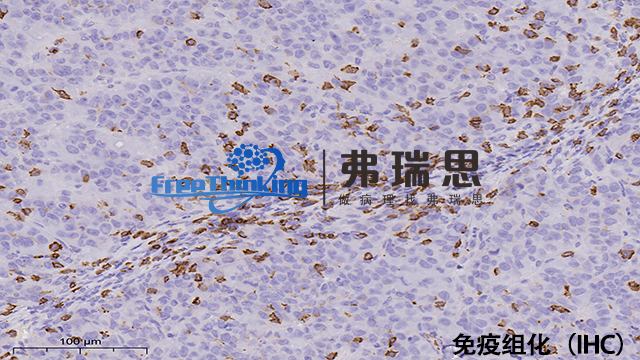
免疫组化常见问题有以下几种。一是非特异性染色,可能由于抗体不纯、封闭不充分等原因,可通过优化抗体浓度、加强封闭步骤解决。二是染色弱或无染色,可能是抗体失效、抗原修复不当等,需检查抗体活性、调整修复方法。三是背景染色过强,可能因为清洗不彻底、抗体浓度过高,可增加清洗次数、降低抗体浓度。四是组织脱片,可能是载玻片处理不当或烤片时间不够,应确保载玻片清洁并充分烤片。五是不同批次染色结果差异大,可能是实验条件不稳定,需严格控制实验流程和条件。分析这些问题时,要综合考虑样本处理、抗体质量、实验操作等因素,以提高免疫组化实验的准确性和可靠性。衢州病理切片免疫组化实验流程免疫组化帮助了解疾病的发生机制。
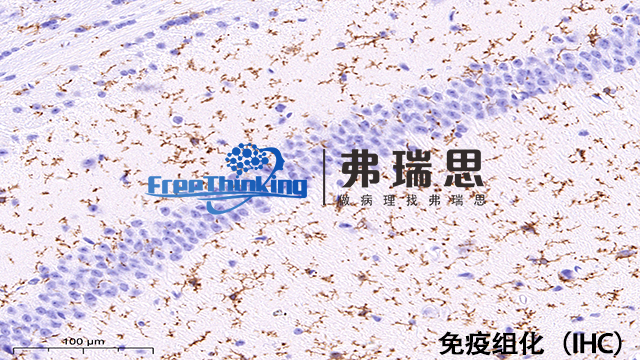
免疫组化即免疫组织化学技术,其原理是利用抗原与抗体特异性结合的特性。首先,将组织样本进行处理,如固定、切片等,使其保持良好的形态结构。然后,加入针对特定抗原的抗体,该抗体能够与样本中的目标抗原特异性结合。接着,再加入带有标记物(如酶、荧光素等)的二抗,二抗能够与一抗结合。通过标记物的显色反应或发出荧光等方式,使目标抗原在组织中的位置得以显现。这样就可以在显微镜下观察到特定抗原在组织中的分布情况,从而对组织中的蛋白质等分子进行定位、定性及相对定量分析,为疾病诊断和研究提供重要依据。
免疫组化技术具有以下优点:一、特异性强1.利用抗原与抗体的特异性结合,能够准确识别特定的蛋白质、多肽等生物分子在组织或细胞中的位置和表达情况,避免了非特异性染色带来的干扰,为研究特定分子的功能和作用提供了可靠的依据。二、定位准确1.可以精确显示目标分子在细胞内的分布,如在细胞核、细胞质还是细胞膜。这有助于深入了解生物分子在细胞中的具体作用部位,以及与其他细胞结构的关系。三、灵敏度高1.能够检测出低丰度的生物分子。即使目标分子在组织或细胞中的含量很少,通过合适的抗体和显色方法,也能被清晰地显示出来,为研究微量分子的生物学意义提供了可能。四、形态学结合1.将形态学观察与分子水平的检测相结合。在观察组织或细胞的形态结构的同时,了解特定生物分子的表达情况,为疾病诊断和研究提供更准确的信息。在Tumor研究中,免疫组化是鉴定Tumor标志物、了解其表达模式的关键工具。
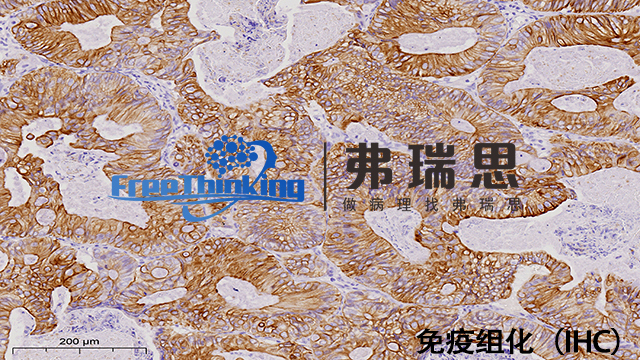
免疫组化即用型二步法实验流程如下:一是样本处理。将组织切片进行固定、脱蜡、水化等操作,使组织保持良好的形态结构并便于后续抗体结合。二是抗原修复。根据需要选择合适的抗原修复方法,如热修复或酶修复,使抗原表位充分暴露。三是阻断内源性过氧化物酶。使用相应试剂处理切片,防止内源性酶干扰染色结果。四是一抗孵育。直接滴加即用型一抗于切片上,在合适的温度和湿度下孵育一定时间,使一抗与抗原特异性结合。五是二抗孵育。去除一抗后,滴加即用型二抗,再次孵育,二抗可与一抗结合并带有显色标记。六是显色。加入显色剂,使结合有二抗的部位呈现出特定颜色。七是复染。用苏木素等对细胞核进行复染,使细胞结构更清晰。八是脱水封片。依次经过脱水透明处理后,用封片剂封片,便于显微镜下观察。多重免疫组化技术进步,实现同时检测多种蛋白表达。衢州病理切片免疫组化实验流程
特异性抗体的选择是决定免疫组化实验成功与否的重要因素之一。衢州病理切片免疫组化实验流程
免疫组化镜检是一种利用免疫学原理和显微镜观察技术相结合的方法。首先,通过特定抗体与组织或细胞中的抗原发生特异性结合,然后使用带有标记的二抗进行显色或荧光标记。在显微镜下观察时,这些标记物会呈现出不同的颜色或荧光信号,从而显示出目标抗原在组织或细胞中的分布位置及表达水平。例如,在病理诊断中,通过免疫组化镜检可以检测特定蛋白质的表达情况,帮助判断疾病的类型、进展程度等。它可以精确地定位抗原,使研究者能够直观地观察到细胞或组织中的特定分子变化,为疾病的诊断和研究提供重要的依据。该技术具有较高的特异性和敏感性,能够在微观层面上对生物样本进行深入分析。衢州病理切片免疫组化实验流程