商机详情 -
济南正规外泌体提取试剂进货价
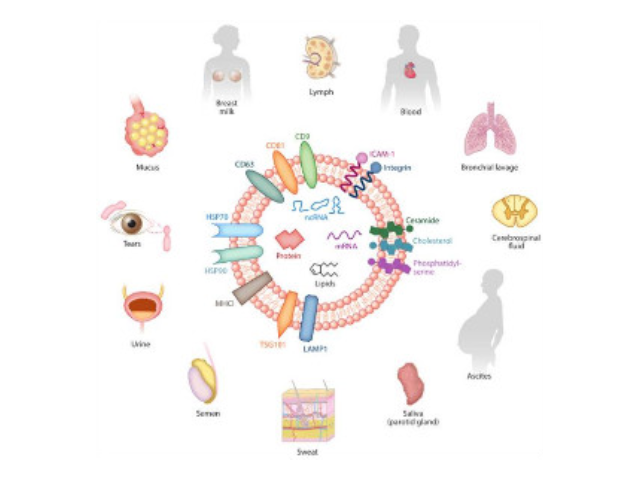
1983年,外泌体初次于绵羊网织红细胞中被发现,1987年Johnstone将其命名为“exosome”。多种细胞在正常及病理状态下均可分泌外泌体。其主要来源于细胞内溶酶体微粒内陷形成的多囊泡体,经多囊泡体外膜与细胞膜融合后释放到胞外基质中。所有培养的细胞类型均可分泌外泌体,且外泌体天然存在于体液中,包括血液、唾液、尿液、脑脊液和乳汁中。有关他们分泌和摄取及其组成、“运载物”和相应功能的精确分子机制刚刚开始研究。外泌体目前被视为特异性分泌的膜泡,参与细胞间通讯,对外泌体的研究兴趣日益增长,无论是研究其功能还是了解如何将其用于微创诊断的开发。如何高效地提取外泌体是实现这项新兴液体活检技术临床常规化应用的关键。通过过滤膜对上述体液样本进行过滤,进一步去除体液中的细胞残片及其他杂质。济南正规外泌体提取试剂进货价

外泌体的提取、分离方法:尺寸排阻色谱法和超滤法;尺寸排阻色谱法是利用分子筛理论,较初是根据蛋白质分子大小分离蛋白质的色谱技术。该方法的主要优点是不需要很大的离心力,从而保证了外泌体的完整性。Mol等[13]对比超高速离心和尺寸排阻色谱法得到的外泌体蛋白,结果显示,后者得到的外泌体的蛋白丰度高于前者。这些基于过滤或尺寸排阻色谱的新方法为外泌体大规模的生产和临床应用提供了可能。超滤也是根据外泌体的尺寸将其分离出来的一种方法,超滤一般被认为是外泌体分离过程中的一个准备过程,通过超滤除去大分子和小分子的蛋白质。不过连续的超滤可以分离出外泌体,和超高速离心相比,超滤不需要特殊的设备就可以较短时间内分离出外泌体。但是,超滤膜对外泌体的黏附作用会降低外泌体的产量,并且超滤过程中施加的外力可能会使外泌体变形或者破裂。济南正规外泌体提取试剂进货价外泌体的提取、分离方法:免疫亲和层析法。
外泌体的提取、分离方法:梯度密度离心法。研究发现,外泌体的密度在1.1~1.19kg·L-1之间,因此,可以采用密度梯度离心法来分离外泌体。该方法是将超速离心结合蔗糖密度梯度或蔗糖垫结合,原理是先除去非囊泡物质,再通过梯度密度浓缩提取外泌体,该方法可以得到相对较为纯净的外泌体。传统的梯度密度方法通常需要离心16h,但是2012年,研究者[15]使用了62~90h才分离出某些确切囊泡,因此,该方法可能不足以沉淀所有的外泌体。如果离心时间不充足,污染物质可能和外泌体保持在相同的密度层,特别是这个密度范围又比较宽。
外泌体的提取分离:1、超速离心法(差速离心)。超离法是常用的外泌体纯化手段,采用低速离心、高速离心交替进行(如图所示),可分离到大小相近的囊泡颗粒。超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。2、密度梯度离心。在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。通过密度梯度离心,样品中的外泌体将在1.13-1.19g/ml的密度范围富集。此法获得的外泌体纯度较高,但步骤繁琐,耗时。外泌体提取:样本的粘度与分离的外泌体纯度有显着的相关性。
外泌体的提取、分离方法:免疫亲和层析法。免疫亲和层析法是利用生物体内存在的抗原、抗体之间高度特异性的亲和力进行分离的方法,主要用于生物大分子的分离、纯化。将其应用于外泌体的分离主要是借助外泌体表面的特异性抗体,如TSG101或四跨膜蛋白。此方法的原理是利用抗原抗体的特异性结合,只有囊泡表面有特异性的抗体才可以被识别,这使得提取的外泌体纯度高,但是产量低。Zarovni等分别用超速离心、密度梯度离心和免疫层析法,从血浆和细胞上清中提取外泌体蛋白,结果表明,免疫亲和层析法得到的外泌体表面存在多种标记蛋白(Alix、CD9、CD63),同时,ELISA和PCR结果也证明了该方法的可行性。外泌体提取:重复离心操作还有可能对囊泡造成损害,从而降低其质量。济南正规外泌体提取试剂进货价
在超速离心力作用下,使蔗糖溶液形成从低到高连续分布的密度阶层,是一种区带分离法。济南正规外泌体提取试剂进货价
在这项新的研究中,经过基因修饰的外泌体(被称作iExosome)能够运送特异性地靶向KRAS突变基因的小RNA分子,从而导致胰腺病模式小鼠病情缓解,增加它们的总存活率。这些研究人员采用了一种被称作RNA干扰(RNAi)的靶向方法:利用这些天然的纳米颗粒(即外泌体)运送小干扰RNA(siRNA)或短发夹RNA(shRNA)分子来靶向胰腺病细胞中的KRAS突变基因,从而影响多种胰腺病模型的一些病症负荷和存活。他们证实外泌体能够作为一种高效的RNAi载体发挥作用,这是因为这些纳米大小的囊泡(即外泌体)轻松地在体内迁移和进入靶细胞(包括病细胞)中。济南正规外泌体提取试剂进货价